简答题
正确答案
(1)HA+NaOH=NaA+H2O
物质量比为1:1,得到1.250/M=0.1×37.1010-3
得M=336.93g•mol-1
(2)(37.1-7.42)0.10=2.968mmol
0.742mmolNaA与2.968mmol的HA构成了缓冲溶液
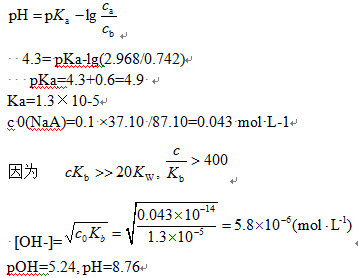
物质量比为1:1,得到1.250/M=0.1×37.1010-3
得M=336.93g•mol-1
(2)(37.1-7.42)0.10=2.968mmol
0.742mmolNaA与2.968mmol的HA构成了缓冲溶液
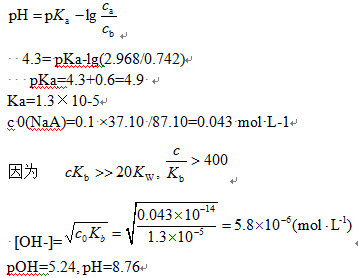
答案解析
略